Metalobiología de desórdenes neurodegenerativos: Química Bioinorgánica de la enfermedad de Parkinson
Aunque no está claro cómo la proteína αS puede iniciar la muerte neuronal, lo cierto es que la agregación amiloide de αS es fundamental para los efectos patológicos asociados con la enfermedad de Parkinson (EP). En este sentido, la interacción de αS con iones metálicos desempeña un papel importante en la aceleración de la agregación amiloide y podría representar el vínculo entre los procesos patológicos de agregación, daño oxidativo y muerte de células neuronales. De hecho, la relación entre la afinidad de αS por los iones metálicos y la eficacia en la que éstos aceleran la agregación molecular de αS reveló la existencia de una jerarquía de interacciones metal-proteína. Concretamente, la especificidad de unión de cobre a αS indica que el mecanismo a través del cual el cobre impacta sobre su agregación difiere significativamente de la ejercida por otros iones metálicos. Es por esto que la química de coordinación de cobre a la proteína αS ha merecido tanta atención en los últimos años. En un principio, la mayoría de los estudios sobre la interacción de cobre con αS se direccionaron a elucidar el entorno de coordinación de Cu(II), siendo escasa la información relacionada a la estructura, afinidad y reactividad de los complejos αS-Cu(I). Esta situación cambió en los últimos años, desde que varios grupos de investigación enfocaron sus estudios en la química asociada Cu(I)/dioxígeno y en las características de unión de Cu(I) a αS. En este contexto, en el MPLbioR determinamos que los residuos de Met1 y Met5 en el extremo N-terminal de αS constituyen determinantes estructurales claves para la unión de alta afinidad de Cu(I) a la región N-terminal de αS (K
cond=5μM); dichos residuos mostraron una alta susceptibilidad a la oxidación catalizada por cobre en presencia de oxígeno. Además, se identificó un segundo sitio de unión de menor afinidad que involucra al anillo imidazólico de His50 (K
cond=20 μM). Mediante estudios por RMN se determinó que la unión de Cu(I) a la región N-terminal de αS induce una estructura secundaria del tipo hélice-alfa estable y rígida en los primeros 10 residuos, que se extiende hasta el residuo 25 de la secuencia primaria, adquiriendo mayor grado de flexibilidad conformacional en el segmento 11-25. Nuestros estudios demostraron que la presencia de ambos residuos de metionina es determinante para la unión de alta afinidad de Cu(I) a la proteína, mientras que el grupo acetilo en el extremo N-terminal y el residuo de Asp2 cumplen un rol estabilizador de la estructura secundaria inducida por la unión del ion metálico. Estos hallazgos podrían tener significancia fisiológica considerando que tanto la unión a vesículas lipídicas como la agregación amiloide de αS son procesos fuertemente modulados por el contenido de estructura secundaria del tipo α-hélice en la región N-terminal de la proteína. En este sentido, estudios recientes indican que en presencia de cobre, la proteína αS sufre una relocalización intracelular que modifica la relación entre los niveles de la proteína unida a membrana y en citosol.
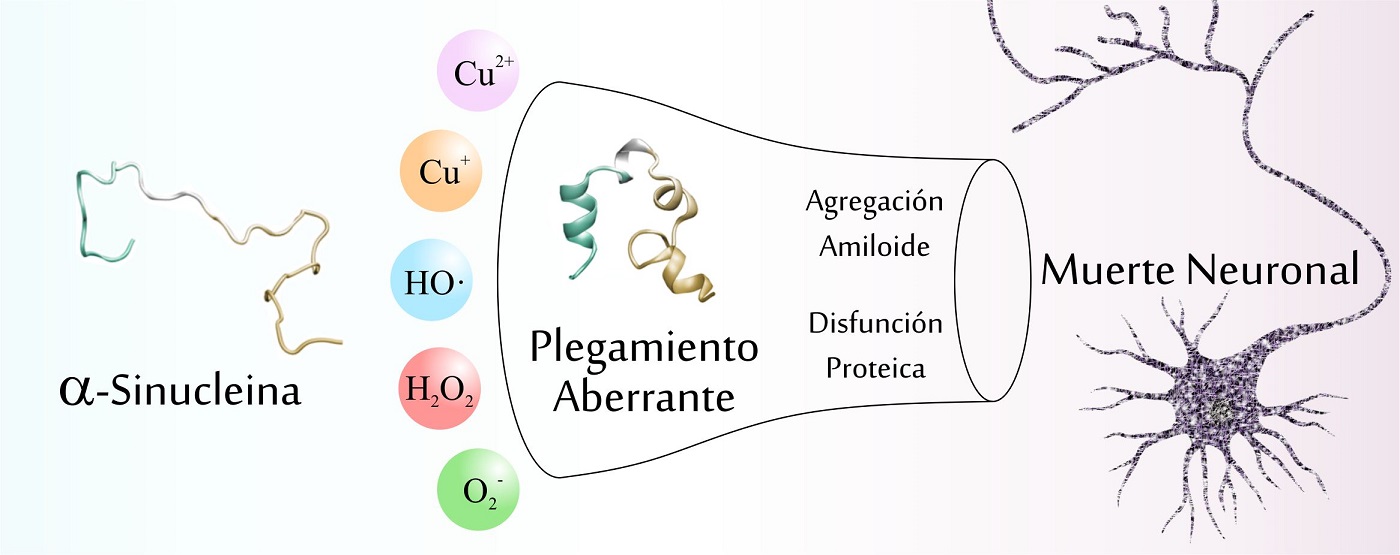
Para avanzar en estos conocimientos, en el MPLbioR estamos estudiando estos aspectos tanto in vitro como en modelos celulares de la EP especialmente diseñados para el estudio de la oligomerización y formación de inclusiones intracelulares de αS.
Publicaciones representativas
Binolfi A, Valiente-Gabioud AA, Duran R, Zweckstetter M, Griesinger C, Fernandez
CO. Exploring the Structural Details of Cu(I) Binding to α-Synuclein by NMR
Spectroscopy. (2011) J Am Chem Soc 133:194-196.
Miotto MC, Valiente-Gabioud AA, Rossetti G, Zweckstetter M, Carloni P, Selenko P,
Griesinger C, Binolfi A, Fernández CO. Copper binding to the N-terminally acetylated,
naturally occurring form of alpha-synuclein induces local helical folding (2015) J Am
Chem Soc 137:6444-6447
Villar-Piqué A, Lopes da Fonseca T, Sant'Anna R, Szegö ÉM, Fonseca-Ornelas L,
Pinho R, Carija A, Gerhardt E, Masaracchia C, Abad Gonzalez E, Rossetti G, Carloni
P, Fernández CO, Foguel D, Milosevic I, Zweckstetter M, Ventura S, Outeiro TF.
Environmental and genetic factors support the dissociation between α-synuclein
aggregation and toxicity. (2016) Proc Natl Acad Sci U S A 113:E6506-E6515.
Gentile I, Garro HA, Delgado Ocaña S, Gonzalez N, Strohäker T, Schibich D,
Quintanar L, Sambrotta L, Zweckstetter M, Griesinger C, Menacho Márquez M,
Fernández CO. Interaction of Cu(I) with the Met-X3-Met motif of alpha-synuclein:
binding ligands, affinity and structural features. (2018) Metallomics 10:1383-1389. doi:
10.1039/c8mt00232k.
González N, Arcos-López T, König A, Quintanar L, Menacho Márquez M, Outeiro TF,
Fernández CO. Effects of alpha-synuclein post-translational modifications on metal
binding (2019) J Neurochem 150:507-521. doi: 10.1111/jnc.14721.
Colaboradores
Liliana Quintanar
Department of Chemistry, Center for Research and Advanced Studies (Cinvestav),
Mexico City, Mexico
Nicolás Rey
Departamento de Química, Pontifícia Universidade Católica do Rio de Janeiro, Rio de
Janeiro, RJ, Brazil
Paolo Carloni
Computational Biomedicine, Institute for Neuroscience and Medicine and Institute for
Advanced Simulations, Forschungszentrum Jülich, Jülich, Germany;
Faculty of Mathematics, Computer Science and Natural Sciences, Aachen, Germany
Institute for Neuroscience and Medicine, Forschungszentrum Jülich, Jülich, Germany